客製化服務, GeneDireX 客製化服務
胜肽合成(Peptide Synthesis)基本原理及應用
本文章由GeneDireX技術支援提供
胺基酸構造: 如圖一
- 胺基(-NH2 ): N-terminal
- 羧基(-COOH): C-terminal
- R: residue

胜肽簡介:
為一胺基酸序列,長度約2~170 個胺基酸,其功能與胺基酸序列組成相關,一般結構上與蛋白質相比,較少有四級和3D結構。應用上可以是具有活性的荷爾蒙、神經傳導物質、生長因子、訊息傳遞物質以及抗體。多樣的功能使得胜肽在各種研究上是一個目標物,例如: 抗體表位專一性研究、疫苗的開發、蛋白質功能研究、蛋白質特定分析及鑑定、酵素與受質交互作用、受體與受質專一性辨認研究,甚至能當作治療疾病的藥物或是當作胜肽序列分析的標準品。
胜肽合成方式:
藉由醯胺基鍵結(amide bond)連接胺基酸: COOH+NH2→O=C-NH+H2O,胺基酸構造具有N端、C端及殘基(residue)合成時皆須用保護基保護,常見的保護基有二種: tert-butoxycarbonyl(Boc)及9-fluorenylmethoxycarbonyl(Fmoc)
固相合成法(1-3),如圖二(4):
- 胺基酸合成單體的C端接在一固相材質上
- 單體的N端、C端及residue皆由保護基保護以防止與其他胺基酸反應
- 將N端去保護基,要接上的另一個胺基酸C端也去除保護基
- 去保護基的胺基酸進行耦合反應(coupling)
- 重複2~4步驟直到完成整鏈的胜肽
- 從初步合成好的胜肽移除剩餘的保護基,並將胜肽從固相材質上分離後進行純化
- 以HPLC純化及質譜儀確認其純度及正確性
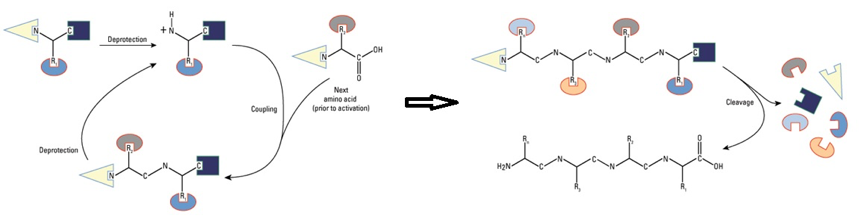
圖二、胜肽合成方式
訂購注意事項:
- 名稱
- 胺基酸序列書寫方向:由 N端→C端
- 重量: 4、10、20、40 mg或以上
- 純度: 不純化、75%、85%、90%或以上
- 修飾:N端修飾或C端修飾
胜肽儲存及處理:
胜肽穩定性依照其序列和 residue特性不同而有所差異,適合的溶液和溶解度也不盡相同。原則上乾粉與回溶後的胺基酸應儲存於-20℃並且避光,操作時避免反覆凍溶。
常見實驗應用依純度需求區分:
|
純度 |
實驗應用 |
|
Crude |
Non-sensitive screening |
|
>75% |
ELISA標準品及peptide array |
|
>85% |
多株抗體製備及半定量酵素受質分析實驗 |
|
>95% |
In vitro and in vivo study及單株抗體製備 |
|
>98% |
In vitro study、in vivo study及臨床試驗 |
移除內毒素的重要性
內毒素(lipopolysaccharide, LPS, 脂多醣)是革蘭氏陰性細菌外膜的主要成分,在胜肽合成過程中可能會被引入。內毒素即使在低濃度也會刺激免疫細胞過多的免疫反應及T細胞的擴張,依照不同型態的細胞及培養條件,內毒素對於細胞生長及功能會有不同的影響(5-8)。
胜肽合成提供二種方法測量內毒素:
- 內毒素分析(endotoxin analysis):測量胜肽裡的內毒素含量
- 內毒素控制(endotoxin control):移除胜肽裡的內毒素並分析其殘餘含量
移除三氟乙酸(trifluoroacetic acid, TFA)的重要性
三氟乙酸在胜肽合成中有三個作用:
- 將胜肽從固相材質上切下來
- 移除保護基
- 增加HPLC純化的效能
在冷凍乾燥時會將多餘的三氟乙酸移除但最終產物中仍會殘留10~45%不等,三氟乙酸對於細胞實驗會有無法預測的干擾,例如在一些細胞中,10nM濃度會抑制細胞生長(9),而在其他細胞中,較高濃度(0.5~7 mM)則會促進細胞存活率(10),而在其他研究上則發現三氟乙酸可以變構調節甘胺酸受體,在甘胺酸較低濃度時增加其受體的活性(11),在不同細胞上促進或抑制細胞存活率會造成實驗結果易有偽陽性或是降低訊號。
而對於動物實驗建議將三氟乙酸移除,因為其蛋白及磷脂質會在胺基三氟乙酸化(trifluoroacetylate)(12),易引起免疫反應,應降低其含量避免引起動物不良免疫反應而影響實驗結果,可換鹽的種類有: 醋酸鹽(acetate)、鹽酸鹽(hydrochloride)、甲酸酯(formate)或磷酸鹽(phosphate),需依實驗需求以及胜肽序列的親疏水性來選擇適合的鹽類。
常見的實驗應用:
|
細胞分析 |
大部分將胜肽視作一個藥物來做細胞處理,分析處理後的細胞反應,觀察下游反應的變化 |
|
動物實驗 |
大部分將胜肽視作一個藥物來做動物實驗,分析藥物作用及藥物代謝機制 |
|
抗體製造 |
單株或多株抗體製備的抗原 |
|
篩選抗體 |
模擬不同的抗體結合區域 |
|
酵素活性評估 |
篩選酵素結合位點 |
|
測試抗體滴度(titer) |
ELISA的標準品 |
常見的修飾
|
螢光標示 (例如FITC) |
Biotin conjugation |
Ahx linker or long carbon (LC) linker |
BSA, KLH and OVA conjugation |
|
D form |
醯胺化 (amidation) |
乙醯化 (acetylation) |
磷酸化(phosphorylation) |
|
甲基化(methylation) |
雙硫鍵 (disulfide bond) |
Side chain modification |
- 螢光標示:接上螢光(例如:FITC)或是FRET pairs,主要用在流式細胞儀分析(flow cytometry)、蛋白間交互作用、定位分析及觀察活細胞內訊號的傳遞
- Biotin conjugation:對於streptavidin及avidin有高度親和力,可用於免疫組織化學染色(IHC)、酵素免疫分析(ELISA)及以螢光為基礎的流式細胞儀分析
- Ahx linker or a long carbon (LC) linker:目的讓修飾物質與胜肽間隔一段距離,以避免相互作用或是遮住辨識位點
- BSA, KLH and OVA conjugation:製造抗體的常見修飾,因胜肽較小較難成功引發免疫反應,攜帶蛋白含有較多抗原表位可以刺激T細胞,接著促進B 細胞反應進而產生抗體
- D form:對蛋白水解酶(protease)較有抗性,相對一般L form胜肽故較不易被水解,藥物及酵素分析實驗較常用到
- 醯胺化(amidation)及乙醯化(acetylation):細胞及動物實驗常用的修飾,移除兩端的電荷,總體溶解度會降低,穩定性會增加,幫助胜肽模擬自然構造,增加生物活性及進入細胞的能力
- 磷酸化(phosphorylation):訊息傳導、基因表現及蛋白間交互作用,在訊息傳導路徑上很多都藉由磷酸化去誘導下游表現,因此磷酸化修飾大多用於這類型的研究
- 甲基化(methylation):甲基化主要是表面遺傳學調控,所以甲基化修飾是模仿蛋白質轉譯後修飾作用之一
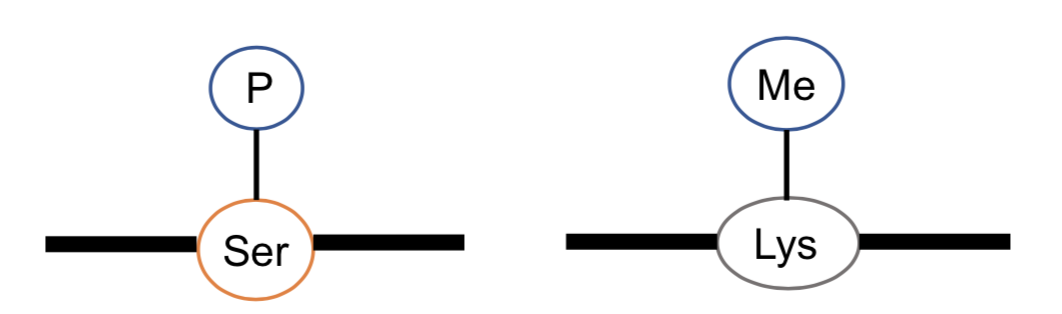
圖三、磷酸化及甲基化示意圖
9. 雙硫鍵(disulfide bond):cysteine雙硫鍵結,thiol group (-SH),形成環狀胜肽,保持生物活性及穩定
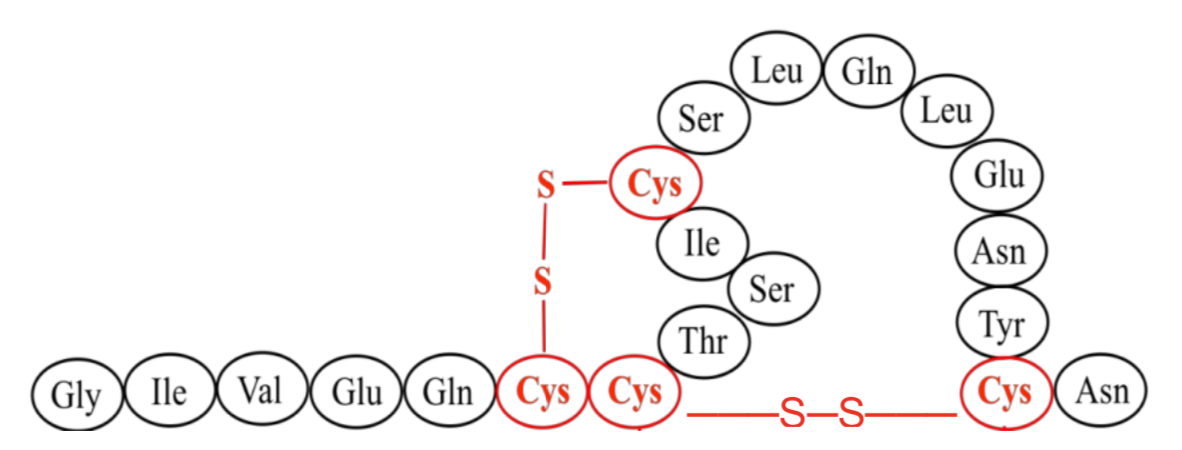 圖四、雙硫鍵結形成環狀
圖四、雙硫鍵結形成環狀
10. Side chain modification:胜肽序列裡在其中一個胺基酸的residue連接到另一條胜肽支鍊
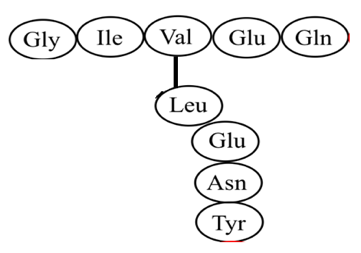 圖五、Side chain modification
圖五、Side chain modification
Reference:
- Veronika Mäde et al.Automated solid-phase peptide synthesis to obtain therapeutic peptides Beilstein J. Org. Chem. (2014)
- Nelson Arispe, Juan Carlos Diaz, and Michael Flora Efficiency of Histidine-Associating Compounds for Blocking the Alzheimer’s Ab Channel Activity and Cytotoxicity Biophysical Journal. (2008)
- Bacsa B.et al. Solid-phase synthesis of difficult peptide sequences at elevated temperatures: a critical comparison of microwave and conventional heating technologies. J Org Chem. (2008)
- https://www.thermofisher.com/us/en/home/life-science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/peptide-synthesis.html
- Michael E. Dawson, The significance of endotoxin to cell culture and biotechnology. Associates of Cape Cod Incorporaion. (1998)
- Case Gould, M.J. Endotoxin in Vertebrate Cell Culture: Its Measurement and Significance. In Uses and Standardization of Vertebrate Cell Lines, Tissue Culture Association. Gaithersburg, MD, (1984)
- Morris, D.D. et al. Endotoxin-Induced Production of Interleukin 6 by Equine Peritoneal Macrophages In Vitro. Am.J.Vet.Res.(1992)
- Yusuke Nomura. et al. A biological study establishing the endotoxin limit for in vitro proliferation of human mesenchymal stem cells. Regenerative Therapy (2017)
- Cornish J, Callon K E, Lin C Q X, et al. Trifluoroacetate, a contaminant in purified proteins, inhibits proliferation of osteoblasts and chondrocytes[J]. American Journal of Physiology-Endocrinology And Metabolism. (1999)
- Ma TG et al. Effects of trifluoroacetic acid, a halothane metabolite, on C6 glioma cells. J Toxicol Environ Health. (1990)
- Tipps ME, Iyer SV, Mihic SJ Trifluoroacetate is an allosteric modulator with selective actions at the glycine receptor. Neuropharmacology (2012)
- Joong-Gon Kim, Doo Ok Jang. Trifluoroacetylation of amines with trifluoroacetic acid in the presence of trichloroacetonitrile and triphenylphosphine. Tetrahedron Letters (2010)
